LYMPHOSEEK 50 microgrammes, trousse pour préparation radiopharmaceutique, trousse pour préparation radiopharmaceutique de 1 flacon de 50 µg
Retiré du marché le : 16/07/2024
Dernière révision : 24/09/2020
Taux de TVA : 2.1%
Laboratoire exploitant : NORGINE SAS
Ce médicament est uniquement à usage diagnostique.
Lymphoseek radiomarqué est indiqué pour l'imagerie et la détection peropératoire des ganglions sentinelles drainant une tumeur primaire chez des patients adultes atteints d'un cancer du sein, d'un mélanome ou d'un carcinome épidermoïde de la cavité buccale.
L'imagerie externe et l'évaluation peropératoire peuvent être effectuées à l'aide d'un appareil de détection des rayonnements gamma.
Hypersensibilité au principe actif ou à l'un des excipients mentionnés à la rubrique Liste des excipients ou à l'un des composants du produit radiomarqué.
Possibilité de réactions d'hypersensibilité ou anaphylactiques
La possibilité d'hypersensibilité, incluant des réactions anaphylactiques / anaphylactoïdes graves, potentiellement mortelles ou fatales, doit toujours être envisagée.
En cas de réaction d'hypersensibilité ou de réaction anaphylactique, l'administration du médicament doit être immédiatement interrompue et un traitement par voie intraveineuse doit être débuté si nécessaire. Afin de permettre une prise en charge rapide en cas d'urgence, il convient d'avoir à disposition immédiate les médicaments et le matériel nécessaires, notamment une sonde d'intubation trachéale et du matériel de ventilation.
Bénéfice individuel/justification des risques
Pour chaque patient, l'exposition aux rayonnements ionisants doit être justifiée par le bénéfice attendu. L'activité administrée doit correspondre à la plus faible dose de rayonnements possible compatible avec l'obtention de l'information diagnostique recherchée.
Insuffisance hépatique et rénale
Il convient d'évaluer attentivement le rapport bénéfice-risque chez ces patients, car une exposition accrue aux rayonnements est possible. La dose de rayonnement estimée reçue par le patient ne devrait pas dépasser 2,28 mSv même si la dose de 74 MBq n'a pas du tout été éliminée (voir rubrique Posologie et mode d'administration).
Préparation du patient
Le patient doit être bien hydraté avant le début de l'examen et uriner aussi souvent que possible au cours des premières heures suivant l'examen afin de réduire l'exposition aux rayonnements ionisants.
Mises en garde particulières
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose et par conséquent est considéré comme exempt de sodium.
Pour les précautions liées aux risques environnementaux, voir la rubrique Précautions particulières d'élimination et de manipulation.
Résumé du profil de sécurité
Dans les essais cliniques portant sur 553 patients, les effets indésirables les plus fréquemment observés sont les suivants:
- irritation au site d'injection (0,7%; 4 patients sur 553)
- douleur au site d'injection (0,2%; 1 patient sur 553)
Les autres effets indésirables étaient peu fréquents, d'une sévérité légère et de courte durée.
Liste des effets indésirables sous forme de tableau
Les études cliniques ont évalué l'incidence des effets indésirables mentionnés ci-dessous chez 553 sujets âgés de 18 ans et plus ayant été traités par Lymphoseek. Ces effets indésirables étaient liés temporellement à l'administration de Lymphoseek et pouvaient être causés par d'autres médicaments administrés aux patients ou aux procédures chirurgicales.
Les effets indésirables observés au cours des études cliniques sont mentionnés ci-dessous par classes de fréquences selon la convention suivante: très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Dans chaque classe de fréquences, les effets indésirables sont présentés par ordre décroissant de gravité.
| Classe de systèmes d'organes | Effet indésirable |
| Troubles du métabolisme et de la nutrition | Peu fréquent: Hypercalcémie |
| Affections du système nerveux | Peu fréquent: Aphasie, vertiges, maux de tête, paresthésie |
| Affections oculaires | Peu fréquent: Vision trouble |
| Affections cardiaques | Peu fréquent: Tachycardie sinusale |
| Affections vasculaires | Peu fréquent: Bouffées vasomotrices |
| Affections gastro-intestinales | Peu fréquent: Nausées |
| Affections de la peau et du tissu sous- cutané | Peu fréquent: Irritation cutanée |
| Affections musculo-squelettiques et systémiques | Peu fréquent: Douleurs au niveau des extrémités, douleurs musculo-squelettiques, douleurs cervicales, douleurs dans la mâchoire |
| Affections du rein et des voies urinaires | Peu fréquent: Impériosité mictionnelle, pollakiurie |
| Affections des organes de reproduction et du sein | Peu fréquent: Douleur mammaire |
| Troubles généraux et anomalies au site d'administration | Peu fréquent: Irritation au site d'injection, douleur au site d'injection, sensation de chaleur |
| Lésions, intoxications et complications liées aux procédures | Peu fréquent: Douleur au site d'incision, sérome, déhiscence de plaie |
L'exposition aux rayonnements ionisants peut entraîner le développement de cancers et d'anomalies héréditaires. Comme la dose efficace pour un adulte (70 kg) est de 1,32 mSv lorsque l'activité maximale recommandée de 74 MBq est administrée, la probabilité de survenue de ces effets indésirables est faible.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
Le
patient doit être bien hydraté avant le début de l'examen et uriner
aussi que possible au cours des premières heures suivant l'examen.
Femmes en âge de procréer
Lorsqu'il est nécessaire d'administrer des produits radiopharmaceutiques chez la femme en âge de procréer, il est important de déterminer si la femme est enceinte ou non. Toute femme n'ayant pas eu ses règles doit être
considérée comme enceinte jusqu'à preuve du contraire. Dans l'incertitude quant à une éventuelle grossesse, (absence de règles, règles irrégulières, etc.), d'autres techniques n'utilisant pas les rayonnements ionisants (le cas échéant) doivent être envisagées.
Grossesse
Il n'existe pas de données sur l'utilisation de Lymphoseek chez la femme enceinte. Aucune étude de toxicité sur la reproduction n'a été réalisée chez l'animal, et on ne sait pas si Lymphoseek peut être préjudiciable au fœtus lorsqu'il est administré à une femme enceinte.
Les examens utilisant des radionucléides chez la femme enceinte entraînent également l'irradiation du fœtus. Seuls les examens impératifs doivent donc être réalisés pendant la grossesse, si le bénéfice attendu excède largement le risque encouru par la mère et le fœtus.
Allaitement
On ne sait pas si le tilmanocept technétié (99mTc) est excrété dans le lait maternel.
Avant d'administrer un produit radiopharmaceutique à une femme qui allaite, il faut envisager de retarder l'examen jusqu'à la fin de l'allaitement ou s'assurer, dans le cas contraire, que le produit radiopharmaceutique le plus approprié a été choisi, compte tenu du passage de la radioactivité dans le lait. Si l'administration est considérée comme indispensable, l'allaitement maternel doit être interrompu pendant 24 heures et le lait tiré doit être éliminé.
Fertilité
Lymphoseek n'a pas fait l'objet d'études de fertilité chez l'animal.
Le fait d'ajouter à Lymphoseek des volumes très importants de traceurs ou d'autres produits d'injection à proximité temporelle ou anatomique pourrait avoir une incidence sur la distribution in vivo de Lymphoseek. Des traceurs supplémentaires ne doivent pas être injectés dans les 30 minutes qui suivent l'administration de Lymphoseek.
Aucune étude d'interaction n'a été réalisée.
Ce médicament est réservé uniquement à l' usage hospitalier .
Le médicament doit être administré uniquement par des professionnels de santé spécialisés dans la réalisation et l'interprétation des procédures de cartographie des ganglions sentinelles.
Posologie
La dose recommandée est de 50 microgrammes de tilmanocept radiomarqué au technétium (99mTc) à 18,5 MBq pour une intervention chirurgicale exécutée le jour même ou à 74 MBq pour une intervention chirurgicale exécutée le lendemain. La dose de 50 microgrammes ne doit pas être ajustée en fonction des différences pondérales. La quantité totale d'injection ne doit pas dépasser 50 microgrammes de tilmanocept, avec une radioactivité totale maximale de 74 MBq) par dose.
Le délai minimum recommandé pour l'imagerie est de 15 minutes après l'injection. La cartographie lymphatique peropératoire peut débuter dès 15 minutes après l'injection.
Les patients dont l'intervention chirurgicale est programmée le jour de l'injection recevront 18,5 MBq de produit radiomarqué au technétium (99mTc). L'administration doit être effectuée dans un délai de 15 heures avant l'heure programmée de l'intervention chirurgicale et de la détection peropératoire.
Les patients dont l'intervention chirurgicale est programmée le lendemain de l'injection recevront 74 MBq de produit radiomarqué au technétium (99mTc). L'administration doit être effectuée dans un délai de 30 heures avant l'heure programmée de l'intervention chirurgicale et de la détection peropératoire.
Populations particulières
Insuffisance hépatique ou rénale
Il convient d'évaluer attentivement l'activité à administrer car la dose effective reçue peut être plus élevée chez ces patients. La dose de rayonnement reçue par le patient ne devrait pas dépasser 2,28 mSv même si la dose de 74 MBq n'a pas du tout été éliminée.
Aucune étude étendue de détermination et d'ajustement de la dose chez des populations normales et particulières n'a été effectuée avec ce médicament. La pharmacocinétique du tilmanocept technétié (99mTc) chez des patients atteints d'insuffisance rénale ou hépatique n'a pas été caractérisée (voir rubrique Propriétés pharmacocinétiques).
Population âgée
Les patients âgés de 65 ans et plus (32 %) ont été évalués dans des études cliniques; aucun problème de sécurité n'a été identifié. Aucune adaptation posologique n'est recommandée sur la base de l'âge.
Population pédiatrique
La sécurité et l'efficacité de Lymphoseek chez les enfants et les adolescents âgés de moins de 18 ans n'ont pas encore été établies. Aucune donnée n'est disponible.
Mode d'administration
Ce médicament doit être radiomarqué avant administration au patient. Le produit radiomarqué est une solution limpide et incolore sans particules visibles.
Suite au radiomarquage, l'administration peut se faire par injection intradermique, sous-cutanée, intratumorale ou péritumorale.
Pour le mélanome, l'administration est intradermique par une injection unique ou par injections multiples séparées.
Pour le cancer du sein, l'administration est intradermique, sous-aréolaire (injection unique ou injections multiples séparées) ou péritumorale (injections multiples séparées).
Pour le carcinome épidermoïde de la cavité buccale, l'administration est péritumorale (injections multiples séparées).
Chaque flacon de 50 microgrammes contient un surremplissage de produit afin de s'assurer que 50 microgrammes de tilmanocept puissent être délivrés. Cependant, il est nécessaire de préparer le flacon selon les indications et d'utiliser une partie aliquote de 50 microgrammes en tant que dose unique par patient.
Le volume de chaque injection ne doit pas dépasser 0,5 mL ou être inférieur à 0,1 mL. Le volume d'injection total ne doit pas être supérieur à 1,0 mL et être inférieur à 0,1 mL. Des volumes de dilution du produit supérieurs à 1,0 mL pourraient avoir une incidence sur la distribution in vivo de Lymphoseek.
Les instructions pour la préparation et le contrôle de la pureté radiochimique du produit radiopharmaceutique sont précisées dans la rubrique 12.
Pour la préparation du patient, voir la rubrique Mises en garde spéciales et précautions d'emploi.
Durée de conservation :
Flacon non ouvert 18 mois.
Après radiomarquage
6 heures. À conserver à une température ne dépassant pas 25 °C en utilisant une protection appropriée contre les rayonnements.
D'un point de vue microbiologique, le produit doit être utilisé immédiatement. S'il n'est pas utilisé immédiatement, la durée et les conditions de conservation avant utilisation relèvent de la responsabilité de l'utilisateur.
Précautions particulières de conservation :
À conserver à une température ne dépassant pas 25 °C.
Conserver le flacon dans l'emballage extérieur à l'abri de la lumière.
Pour les conditions de conservation du médicament après radiomarquage, voir la rubrique Durée de conservation.
La conservation des médicaments radiopharmaceutiques doit s'effectuer conformément à la réglementation nationale relative aux substances radioactives.
Ce médicament ne doit pas être mélangé avec d'autres médicaments à l'exception de ceux mentionnés dans la rubrique Instructions pour l'utilisation, la manipulation et l'élimination et dans la rubrique INSTRUCTIONS POUR LA PRÉPARATION DES RADIOPHARMACEUTIQUES.
La quantité totale d'injection ne doit pas dépasser 50 microgrammes de tilmanocept, avec une radioactivité totale maximale de 74 MBq par dose. Des surdosages chroniques ou aigus sont peu susceptibles de se produire, étant donné la quantité totale d'injection.
Il n'a pas été observé de conséquences cliniques à une dose 3,7 fois la dose recommandée de Lymphoseek chez l'homme, ou à une dose 390 fois l'exposition humaine anticipée au tilmanocept chez l'animal.
En cas d'administration d'un surdosage de rayonnements avec tilmanocept, la dose absorbée par le patient doit être réduite en favorisant autant que possible l'élimination du radionucléide par une augmentation de la fréquence des mictions ou par une diurèse forcée et une vidange fréquente de la vessie.
Classe pharmacothérapeutique: produit radiopharmaceutique à usage diagnostique, détection des tumeurs, Code ATC: V09IA09.
Mécanisme d'action
Lymphoseek est un produit radiopharmaceutique ciblant les récepteurs qui est conçu pour se déplacer rapidement dans les vaisseaux lymphatiques. Il cible biologiquement, s'accumule, est retenu dans les ganglions lymphatiques drainants (ganglions sentinelles) primaires et fortement prédictifs. La substance, le tilmanocept, se lie spécifiquement aux récepteurs de liaison du mannose (CD206) situés à la surface des macrophages et des cellules dendritiques. Les macrophages sont présents en concentrations élevées dans les ganglions lymphatiques.
Le tilmanocept est une macromolécule constituée de plusieurs unités d'acide diéthylènetriaminepentaacétique (DTPA) et de mannose, chacune synthétiquement reliée à un squelette de dextran de 10 kDa. Le mannose agit comme substrat du récepteur, et le DTPA sert d'agent chélatant pour le marquage au technétium (99mTc). Le diamètre moyen du tilmanocept est de 7 nm et cette faible taille moléculaire favorise les déplacements dans les canaux lymphatiques, résultant en une clairance rapide et cohérente au site d'injection.
Suite à la reconstitution et à l'étiquetage, Lymphoseek est destiné à être injecté à proximité immédiate de la tumeur et utilisé dans l'imagerie de détection préopératoire des rayonnements gamma conjointement avec une gamma-caméra fixe (scintigraphie), une tomographie d'émission monophotonique (TEMP), ou une TEMP/tomographie assistée par ordinateur (TEMP/TAO), et/ou en peropératoire conjointement avec une sonde de détection gamma pour localiser les ganglions sentinelles dans les canaux lymphatiques drainant la tumeur.
Dans les études in vitro, le tilmanocept technétié (99mTc) a montré une liaison étroite spécifique aux récepteurs humains CD206 avec une affinité de liaison primaire de Kd = 2,76 x 10-11 M. Dans les études cliniques de phase I, approximativement 0,5 à 1,8 % de la dose est accumulée dans les ganglions lymphatiques drainants par le biais de cette liaison spécifique après 30 minutes. La liaison du tilmanocept technétié (99mTc) est indépendante du type ou de la sévérité de la tumeur.
Efficacité clinique
Dans les études cliniques de phase III, le tilmanocept technétié (99mTc) était détectable dans les ganglions sentinelles en 10 minutes. Dans l'analyse par imagerie externe gamma, il a été démontré que le tilmanocept technétié (99mTc) lié est retenu dans les mêmes ganglions lymphatiques drainants pendant jusqu'à 30 heures. Une lymphoscintigraphie préopératoire a été effectuée chez 100 % de patients atteints d'un mélanome, 100 % de patients atteints d'un carcinome épidermoïde de la tête et du cou, et 82 % de patientes atteintes d'un cancer du sein. Le taux global de concordance entre la localisation des ganglions lymphatiques (déterminée par détection de la radioactivité) par lymphoscintigraphie préopératoire et l'étude peropératoire des ganglions lymphatiques était de 97,8 % pour l'ensemble des patients.
Dans les études cliniques de phase III chez des patientes atteintes d'un cancer du sein dont la cartographie a été réalisée avec le tilmanocept technétié (99mTc) et le colorant bleu vital, le tilmanocept technétié (99mTc) a localisé chez 99,91 % des patientes une moyenne de 2,08 ganglions sentinelles par patient par des méta- analyses à effets fixes. Ces taux étaient significativement supérieurs (p < 0,0001) par rapport à une méta- analyse à effets aléatoires des taux de localisation issus des publications de la littérature, des agents colloïdaux de cartographie lymphatique, telle qu'utilisée dans la pratique clinique en Europe. Dans une méta- analyse à effets fixes de deux études de phase III, le tilmanocept technétié (99mTc) a localisé 99,99 % des ganglions lymphatiques excisés colorés en bleu par un colorant bleu vital (concordance). Alternativement, le colorant bleu vital a localisé 66,96 % des ganglions lymphatiques excisés détectés par le tilmanocept technétié (99mTc) (concordance inverse).
Dans les études cliniques de phase III chez des patients atteints d'un mélanome dont la cartographie a été réalisée avec le tilmanocept technétié (99mTc) et le colorant bleu vital, le tilmanocept technétié (99mTc) a localisé chez 99,89% des patientes une moyenne de 2,30 ganglions sentinelles par patient par des méta- analyses à effets fixes. Ces taux étaient significativement supérieurs (p < 0,0001) par rapport à une méta- analyse à effets aléatoires des taux de localisation issus des publications de la littérature, des agents colloïdaux de cartographie lymphatique, telle qu'utilisée dans la pratique clinique en Europe. Dans une méta- analyse à effets fixes de deux études de phase III, le tilmanocept technétié (99mTc) a localisé 99,99 % des ganglions lymphatiques excisés colorés en bleu par un colorant bleu vital (concordance). Alternativement, le colorant bleu vital a localisé 63,50% des ganglions lymphatiques excisés détectés par le tilmanocept technétié (99mTc) (concordance inverse).
Dans une étude clinique de phase III chez des patients atteints d'un carcinome épidermoïde endobuccal ou cutané, le tilmanocept technétié (99mTc) a localisé les ganglions sentinelles chez 97,59 % des patients ayant subi une évaluation des ganglions lymphatiques. En ce qui concerne le stade pathologique de la collecte des ganglions lymphatiques à partir d'une dissection complète des ganglions lymphatiques, le tilmanocept technétié (99mTc) a localisé correctement les ganglions sentinelles prédictifs de la présence de tumeurs métastatiques chez 38 patients sur 39, pour un taux de faux négatifs de 2,56 %. La précision globale du tilmanocept technétié (99mTc) pour l'identification des patients vrais positifs et vrais négatifs en ce qui concerne la pathologie dans les ganglions lymphatiques localisés était de 98,80 %.
Population pédiatrique
L'Agence européenne des médicaments a différé l'obligation de soumettre les résultats d'études réalisées avec Lymphoseek dans un ou plusieurs sous-groupes de la population pédiatrique pour la visualisation du drainage lymphatique des tumeurs malignes solides à des fins de diagnostic (voir rubrique Posologie et mode d'administration pour les informations concernant l'utilisation dans la population pédiatrique).
DOSIMÉTRIE :
Le téchnetium (99mTc) est produit au moyen d'un générateur (99Mo/99mTc) et décroît en émettant un rayonnement gamma d'une énergie moyenne de 140 keV et une demi-vie de 6,02 heures pour donner du technétium (99Tc) qui, en raison de sa longue demi-vie de 2,13 x 105 ans peut être considéré comme quasi- stable.
L'estimation de la dose de rayonnement pour un certain nombre d'organes est basée sur l'homme de référence et les valeurs S selon la Medical Internal Radiation Dosimetry (MIRD), et a été calculée à partir de données biologiques de fixation aux organes et de clairance sanguine.
Les doses de rayonnement reçues par les organes et les tissus d'un patient moyen (70 kg) par MBq de Lymphoseek radiomarqué sont indiquées dans les tableaux 1 et 2.
Tableau 1. Estimation de la dose absorbée de Lymphoseek chez les patientes atteintes d'un cancer du seina
| Estimation de la dose de rayonnement absorbée pour le cancer du sein, mGy/MBq | |
| Organe cible | Adultes |
| cerveau | 0,0002 |
| sein (site d'injection) | 0,0897 |
| paroi de la vésicule biliaire | 0,0019 |
| paroi du gros intestin inférieur | 0,0007 |
| intestin grêle | 0,0005 |
| estomac | 0,0010 |
| paroi du gros intestin supérieur | 0,0007 |
| reins | 0,0101 |
| foie | 0,0018 |
| poumons | 0,0020 |
| muscle | 0,0005 |
| ovaires | 0,0101 |
| moelle osseuse rouge | 0,0007 |
| os | 0,0010 |
| rate | 0,0015 |
| testicules | 0,0027 |
| thymus | 0,0063 |
| thyroïde | 0,0048 |
| vessie | 0,0032 |
| ensemble du corps (sang)b | 0,0011 |
| Dose efficace (E) (hommes, mSv/MBq) | 0,01600 |
| Dose efficace (E) (femmes, mSv/MBq) | 0,01785 |
a Calculée à partir de données issues de 18 patientes atteintes d'un cancer du sein ayant reçu quatre injections péritumorales de 4, 20, et 100 microgrammes de Lymphoseek.
b Le sang représente une exposition de l'ensemble du corps distincte de mesures indépendantes sur d'autres organes et tissus.
Tableau 2. Estimation de la dose absorbée de Lymphoseek chez les patients atteints d'un mélanomea
| Estimation de la dose de rayonnement absorbée pour le mélanome, mGy/MBq | |
| Organe cible | Adultes atteints d'un mélanome |
| cerveau | 0,0050 |
| sein (site d'injection) | 0,0427 |
| paroi de la vésicule biliaire | 0,0038 |
| paroi du gros intestin inférieur | 0,0031 |
| intestin grêle | 0,0032 |
| estomac | 0,0030 |
| paroi du gros intestin supérieur | 0,0031 |
| reins | 0,0150 |
| foie | 0,0050 |
| poumons | 0,0032 |
| muscles | 0,0024 |
| ovaires | 0,0162 |
| moelle osseuse rouge | 0,0027 |
| os | 0,0047 |
| rate | 0,0032 |
| testicules | 0,0056 |
| thymus | 0,0031 |
| thyroïde | 0,0025 |
| vessie | 0,0076 |
| ensemble du corps (sang)b | 0,0030 |
| Dose efficace (E) (hommes, mSv/MBq) | 0,01094 |
| Dose efficace (E) (femmes, mSv/MBq) | 0,01357 |
a Calculée à partir de données issues de 18 patients atteints d'un mélanome ayant reçu quatre injections intradermiques de 20, 100, et 200 microgrammes de Lymphoseek..
b Le sang représente une exposition de l'ensemble du corps distincte de mesures indépendantes sur d'autres organes et tissus.
Deux essais cliniques de phase I chez des patientes atteintes d'un cancer du sein et une étude de phase I chez des patients atteints d'un mélanome ont été réalisés. L'un des objectifs de ces études était l'évaluation radiopharmaceutique de Lymphoseek.
Distribution
Dans une étude de phase I chez des patientes atteintes d'un cancer du sein, Lymphoseek, aux trois doses testées (4, 20, et 100 microgrammes) a montré une clairance rapide au site d'injection (constantes de taux d'élimination comprises entre 0,222/h et 0,278/h). L'assimilation du tilmanocept technétié (99mTc) dans le ganglion sentinelle primaire a augmenté de façon dépendante de la dose (p = 0,009): L'injection de Lymphoseek en une dose de 4, 20, et 100 microgrammes a produit des taux de ganglion sentinelle primaire (LGS) de 0,09 ± 0,20 pmol, 6,53 ± 2,52 pmol, et 10,58 ± 8,43 pmol de tilmanocept technétié (99mTc), respectivement. Le pourcentage de dose injectée ayant atteint le ganglion sentinelle primaire (% IDGS) était de 0,05 % ± 0,10 %, 0,52 % ± 0,38 %, 0,21 % ± 0,17 % dans les groupes de dose de 4, 20, et 100 microgrammes de Lymphoseek, respectivement. Le pourcentage plasmatique % ID par gramme pour deux doses a atteint un pic après 4 heures; les valeurs moyennes pour les doses de 4 et 100 microgrammes étaient de 0,0090 %/g ± 0,0048 %/g et de 0,0039 %/g ± 0,0046 %/g, respectivement. La dose de 20 microgrammes a atteint un pic après 2,5 heures avec un % ID/g moyen de 0,0023 %/g ± 0,0005 %/g.
Dans la seconde étude de phase I chez des patientes atteintes d'un cancer du sein auxquelles ont été injectés 20 microgrammes de Lymphoseek, la constante moyenne de taux d'élimination du tilmanocept technétié (99mTc) était de 0,299/h et la demi-vie du médicament au site d'injection était de 2,6 h. Le % IDGS était de 1,68 % ± 1,22 % dans le groupe ayant reçu une injection 3 heures avant l'intervention chirurgicale et de 1,81 % ± 2,19 % dans le groupe ayant reçu une injection de Lymphoseek 16 heures avant l'intervention chirurgicale.
Dans l'étude de phase I chez des patients atteints d'un mélanome, Lymphoseek, aux trois doses testées (20, 100, et 200 microgrammes) a présenté une clairance au site d'injection avec des constantes de taux d'élimination comprises entre 0,227/h et 0,396/h, résultant en une demi-vie du médicament au site d'injection de 1,75 à 3,05 h). L'assimilation du tilmanocept technétié (99mTc) dans le ganglion sentinelle primaire a augmenté de façon dépendante de la dose: L'injection de Lymphoseek aux doses de 20, 100, et 200 microgrammes a produit des valeurs LGS de 5,01 ± 8.02 pmol, 17,5 ± 13,7 pmol, et 58,2 ± 41,2 pmol de tilmanocept technétié (99mTc), respectivement. Le % IDGS mesuré dans le ganglion lymphatique primaire était de 0,50 % pour la dose de 20 microgrammes, 0,35 % pour la dose de 100 microgrammes, 0,58 % pour la dose de 200 microgrammes de Lymphoseek. Le pourcentage plasmatique % ID par gramme pour deux doses a atteint un pic après 15 minutes; les valeurs moyennes pour les doses de 20 et 200 microgrammes étaient de 0,0104%/g ± 0,0135%/g et de 0,0065 %/g ± 0,0082%/g, respectivement. La dose de 100 microgrammes a atteint un pic après 1 et 2 heures avec un % ID/g moyen de 0,0018 %/g ± 0,001%/g à chaque point de mesure.
Élimination
Le tilmanocept technétié (99mTc) est éliminé essentiellement par les reins. Le métabolisme du tilmanocept technétié (99mTc) n'a pas été étudié expérimentalement. Le tilmanocept peut être métabolisé dans le foie pour produire les molécules qui le composent, à savoir le dextran (qui est excrété par les reins et/ou métabolisé en glucose), le mannose (un sucre endogène) et l'acide diéthylènetriaminepentaacétique (qui est excrété par les reins). Comme avec tous les métabolites généraux, en particulier ceux dans lesquels le foie joue un rôle important d'élimination, une élimination du tilmanocept technétié (99mTc) par la voie biliaire est également susceptible de se produire.
Le % ID pour le foie, les reins et la vessie, tel que calculé à partir de l'ensemble des examens corporels de patientes atteintes d'un cancer du sein, était inférieur à 2,6 % 1, 2,5 et 12 heures après l'administration (toutes doses confondues). Les % ID pour le foie, les reins et la vessie, tel que calculés à partir de l'ensemble des examens corporels de patients atteints d'un mélanome, étaient compris entre 1,1 % et 3,1 % 1 heure après l'administration, et tous ont diminué à moins de 1 % 12 heures après l'administration.
Lymphoseek n'a aucun effet ou qu'un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicologie en administration unique et répétée et de génotoxicité n'ont pas révélé de risque particulier pour l'homme.
Mises en garde générale
Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans un service agréé. Leur réception, conservation, utilisation, transfert et élimination sont soumis aux réglementations et autorisations appropriées des autorités compétentes.
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection et de qualité pharmaceutique. Les précautions appropriées d'asepsie doivent être prises.
Le contenu du flacon est destiné à être utilisé uniquement pour la préparation et le radiomarquage de Lymphoseek et ne doit pas être administré directement au patient sans avoir été d'abord soumis à la procédure de radiomarquage. Chaque flacon de 50 microgrammes contient un surremplissage de produit afin de s'assurer que 50 microgrammes de tilmanocept puissent être délivrés. Cependant, il est nécessaire de préparer le flacon selon les indications et d'utiliser une partie aliquote de 50 microgrammes en tant que dose unique par patient; tout matériau résiduel doit être jeté après reconstitution et utilisation, voir rubrique 12.
Pour les instructions concernant la reconstitution et le radiomarquage du médicament avant administration, voir la rubrique 12. Le produit radiomarqué est une solution limpide et incolore sans particules visibles.
Si à un moment quelconque lors de la préparation de ce médicament, l'intégrité du flacon est compromise, le produit ne doit pas être utilisé.
Les procédures d'administration doivent être effectuées de manière à limiter le risque de contamination du médicament et d'irradiation des opérateurs. Un blindage adéquat est obligatoire.
Avant la préparation extemporanée, le contenu de la trousse n'est pas radioactif. Cependant, après l'ajout du pertechnétate (99mTc) de sodium, les mesures de protection appropriées de la préparation finale doivent être maintenues.
L'administration de produits radiopharmaceutiques présente des risques pour l'entourage du patient en raison de l'irradiation externe ou de la contamination par l'urine, les vomissements, etc. Des mesures de protection contre les rayonnements doivent donc être prises, conformément aux réglementations nationales.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur sur le plan local.
INSTRUCTIONS POUR LA PRÉPARATION DES RADIOPHARMACEUTIQUES :
Normes de radioprotection - manipulation du produit
Utiliser des gants imperméables, une protection efficace contre les rayonnements, et des mesures de sécurité appropriées lors de la manipulation de Lymphoseek afin d'éviter toute exposition inutile du patient, des travailleurs, du personnel clinique, et de toute autre personne aux rayonnements.
Les produits radiopharmaceutiques ne peuvent être utilisés que par des professionnels de santé qualifiés ayant suivi une formation spécifique et sachant utiliser et manipuler des radionucléides en toute sécurité et dont l'expérience et la formation ont été approuvées par les autorités gouvernementales compétentes pour délivrer les autorisations d'utiliser des radionucléides, ou sous le contrôle de tels professionnels de santé.
![]()
Prescriptions de radiomarquage du flacon contenant 50 microgrammes de poudre de tilmanocept marqué au technétium (99mTc)
Considérations générales
Les composants du flacon contenu dans la trousse sont stériles, non pyrogènes, et sont destinés exclusivement à être utilisés pour la préparation de Lymphoseek. Ne pas administrer les composants du flacon non préparé contenu dans la trousse directement à un patient.
Suivre les procédures aseptiques lors de la préparation et de l'administration.
Suivre les précautions de sécurité en matière de radioprotection appropriées lors de la préparation et de l'administration. Utiliser une protection contre les rayonnements pour Lymphoseek radiomarqué afin d'éviter toute exposition aux rayonnements.
Utiliser uniquement un éluat de générateur de technétium (99mTc) ayant été préalablement élué dans les 8 heures. Afin d'obtenir la meilleure pureté radiochimique, reconstituer avec un éluat de générateur de technétium (99mTc) fraichement élué.
Les réactions de marquage par le technétium (99mTc) nécessitent le maintien de l'ion stanneux à l'état réduit. Une solution injectable de pertechnétate (99mTc) de sodium contenant des oxydants ne doit pas être utilisée pour la reconstitution du flacon de la trousse. Les flacons sont scellés sous azote; l'air ou l'oxygène est dangereux pour le contenu du flacon et le flacon ne doit donc pas être ouvert.
La solution injectable radiomarquée de Lymphoseek doit être utilisée dans les 6 heures après reconstitution. La dose doit contenir au moins le taux voulu de radioactivité (99mTc) pour une intervention chirurgicale exécutée le jour même (18,5 MBq) ou pour une intervention chirurgicale exécutée le lendemain (74 MBq) au moment de l'administration.
Détermination des volumes d'injection
Lymphoseek peut être administré à un patient par une injection unique ou par injections multiples. Avant la préparation, déterminer la technique d'injection prévue et le nombre d'injections qui sera utilisé pour un patient donné. Pour chaque injection, préparer une seringue distincte. En fonction du nombre de seringues d'injection prévu et du volume total d'injection prévu par patient, déterminer (à partir du tableau 3 ci- dessous) le volume de reconstitution du flacon de Lymphoseek radiomarqué.
Chaque flacon de Lymphoseek, après reconstitution et radiomarquage, devrait contenir 50 microgrammes de produit avec un surremplissage s'il est préparé selon les instructions et administré comme noté dans le tableau 3. Le surremplissage est de 12,5 microgrammes afin de permettre le test de pureté radiochimique et s'assurer que 50 µg de tilmanocept puissent être délivrés. Le contenu total du flacon ne doit pas être administré à un seul patient. Le produit radiomarqué doit être utilisé dans les 6 heures après sa préparation. Éliminer tout produit non utilisé.
Tableau 3. Injections de Lymphoseek par volume d'injection
| Nombre d'injections désirées | Volume total à injecter | Volume total de reconstitution d'un flacon de Lymphoseek |
| 1 injection de 0,1 mL | 0,1 mL | 0,125 mL |
| 5 injections de 0,1 mL, ou 2 injections de 0,25 mL, ou 1 injection de 0,5 mL | 0,5 mL | 0,625 mL |
| 5 injections de 0,2 mL, ou 4 injections de 0,25 mL, ou | 1,0 mL | 1,25 mL |
| 2 injections de 0,5 mL | | |
Méthode de préparation
La préparation de la solution injectable de Lymphoseek radiomarqué de la trousse est réalisée selon les procédures aseptiques suivantes:
Avant radiomarquage, vérifier que le flacon contenant la poudre de tilmanocept n'est pas endommagé. Ne pas utiliser si l'intégrité du flacon est compromise.
Pour le radiomarquage, utiliser une solution de pertechnétate (99mTc) de sodium à partir d'un générateur de technétium (99mTc) dans les 8 heures après son élution.
Ne pas ouvrir le flacon contenant la poudre de tilmanocept avant ou pendant le radiomarquage.
À l'aide d'une seringue stérile, prélever de façon aseptique approximativement 23,1 MBq ou 92,5 MBq d'une solution de pertechnétate (99mTc) de sodium dans un volume d'environ 0,125 mL (pour un volume de reconstitution du flacon de 0,125 mL) ou bien d'environ 0,5 mL (pour un volume de reconstitution du flacon de 0,625 mL ou 1,25 mL). Contrôler l'activité du technétium (99mTc) de la seringue à l'aide d'un activimètre.
Avant radiomarquage, inscrire sur l'étiquette pour flacon de produit radioactif la quantité de radioactivité, le volume de reconstitution du flacon, la date et l'heure du contrôle, le délai de péremption et le numéro de lot et coller la sur le flacon contenant la poudre de tilmanocept. Placer le flacon dans une protection contre les rayonnements et désinfecter le bouchon avec un tampon alcoolisé.
Ajouter de façon aseptique une solution de pertechnétate (99mTc) de sodium (issue de l'étape d) ci-dessus) au flacon contenant la poudre de tilmanocept. Sans retirer l'aiguille, purger l'espace de tête. Ne pas ouvrir.
Retirer l'aiguille, agiter doucement le flacon par rotations rapides pour en mélanger le contenu, puis laisser reposer à température ambiante pendant au moins 15 minutes.
Le cas échéant, ajouter de façon aseptique une solution injectable stérile de chlorure de sodium à
9 mg/mL (0,9 %) au produit radiomarqué dans le flacon contenant la poudre de tilmanocept de manière à porter le volume au volume de reconstitution du flacon de 0,125 mL, 0,625 mL, ou 1,25 mL avant de remplir la ou les seringues de la dose destinée au patient. Pour normaliser la pression, purger l'espace de tête.
Contrôler la radioactivité totale du flacon radiomarqué à l'aide d'un activimètre. Inscrire la concentration d'activité du technétium (99mTc), le volume total, la date et l'heure du contrôle, le délai de péremption, et le numéro de lot sur l'étiquette pour protection fournie avec la trousse. Coller l'étiquette sur la protection.
Déterminer la pureté radiochimique du produit radiomarqué comme décrit ci-dessous.
Retirer le volume requis de produit radiomarqué à l'aide du nombre nécessaire de seringues. Contrôler la ou les seringues à l'aide d'un activimètre. Inscrire la quantité de radioactivité, la date et l'heure du contrôle, le volume et le délai de péremption (il ne doit pas dépasser 6 heures après la préparation) sur une étiquette pour seringue et la coller sur la ou les seringues.
Conserver le produit radiomarqué dans une protection. À conserver à une température ne dépassant pas 25 °C. Utiliser dans le délai de péremption mentionné sur l'étiquette.
Détermination de la pureté radiochimique de Lymphoseek radiomarqué
Déterminer la pureté radiochimique de Lymphoseek radiomarqué par chromatographie instantanée sur couche mince (CICM) en utilisant du papier chromatographique de cellulose «Whatman Grade 1, 3MM, 31ET Chr» ou «Biodex 150-001 Red Strips» selon la méthode suivante:
Tracer sur la plaque chromatographique, les lignes de dépôt, médiane et de front de solvant à l'aide d'un crayon, comme montré ci-dessous:
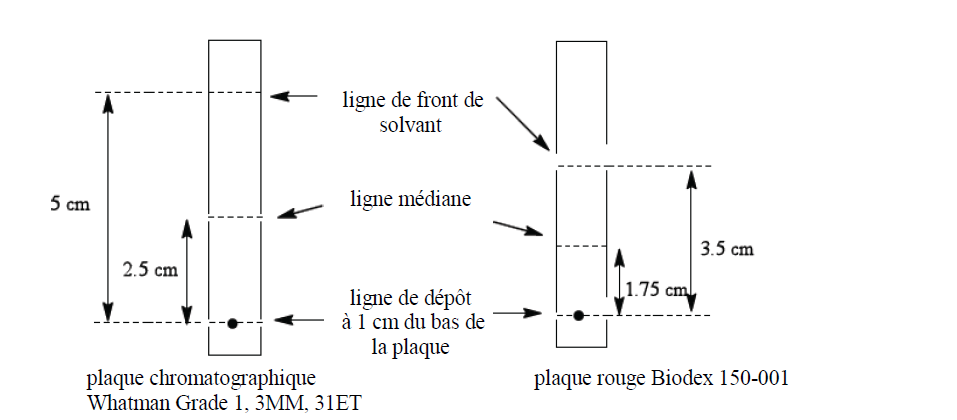
Appliquer une petite goutte (3 à 10 microlitres) de produit radiomarqué au centre de la ligne de dépôt de la plaque chromatographique.
Placer la plaque dans une chambre de chromatographie contenant 1 mL d'acétone en tant que solvant d'élution. Laisser le solvant migrer jusqu'à la ligne de front de solvant (à 5 cm du bas de la plaque Whatman et à 3,5 cm du bas de la plaque Biodex). Retirer la plaque de la chambre, laisser la sécher et couper la par la moitié. Procéder à un comptage de chaque moitié de la plaque à l'aide d'un appareil de comptage de la radioactivité (activimètre ou analyseur multicanaux).
Calculer le pourcentage de pureté radiochimique (% PRC) comme suit:
Ne pas utiliser Lymphoseek radiomarqué si la pureté radiochimique est inférieure à 90 %.
Acquisition des images/cartographie des ganglions sentinelles
Applications chez les adultes atteints d'un cancer du sein, d'un mélanome ou d'un carcinome épidermoïde de la cavité buccale:
- Dans les études cliniques, les patients ont reçu Lymphoseek jusqu'à 30 heures avant l'intervention chirurgicale. Un compteur gamma portatif (représenté par une quelconque sonde de détection gamma portative) a été utilisé en peropératoire pour identifier le technétium (99mTc) permettant de localiser les ganglions sentinelles. Dans les études cliniques utilisant Lymphoseek, les investigateurs de l'étude ont employé une règle de seuil pour la localisation positive du technétium (99mTc) qui a été estimée en utilisant le comptage de la radioactivité de fond plus trois écarts types du taux de comptage moyen du bruit de fond (c'est-à-dire, la règle des trois sigmas, représentant une différence probable > 99,7 % par rapport au bruit de fond) [voir tableau 4]. Le comptage du bruit de fond a été généralement déterminé à partir de tissus distants d'au moins 20 centimètres du site d'injection.
Tableau 4. Exemple de seuil déterminé par la règle des trois sigmas
| Comptage du bruit de fonda | Valeur du seuil à trois sigmas |
| 5 | 11,71 |
| 10 | 19,49 |
| 15 | 26,62 |
| 20 | 33,42 |
| 25 | 40,00 |
- Tous les agents de cartographie lymphatique utilisent des éléments du système lymphatique pour la distribution. L'imagerie et la détection des ganglions sentinelles avec Lymphoseek dépendent de son ciblage moléculaire spécifique et de la liaison aux cellules réticulo-endothéliales à l'intérieur des ganglions lymphatiques. La distorsion de l'architecture et de la fonction du système lymphatique sous- jacent suite à une intervention chirurgicale importante, à une exposition à des rayonnements, ou à une maladie métastatique peut entraîner une localisation moins bonne de Lymphoseek dans les ganglions lymphatiques. Sur la base des études cliniques, le taux de localisation (pourcentage de tous les patients présentant au moins un ganglion critique) et le degré de localisation (nombre moyen de ganglions critiques par patient) de Lymphoseek ne dépendent pas de la technique d'injection du produit radiopharmaceutique. L'utilisation de Lymphoseek est destinée à compléter la palpation, l'inspection visuelle, et d'autres procédures importantes pour la localisation des ganglions lymphatiques. La cartographie lymphatique peropératoire par détection des rayonnements gamma peut débuter dès 15 minutes après l'injection et dans un délai de 30 heures (pour une intervention chirurgicale exécutée le lendemain) après l'administration de Lymphoseek.
- Après injection de Lymphoseek, l'imagerie externe par détection des rayonnements gamma peut être réalisée. Le délai recommandé pour l'imagerie préopératoire est de 15 minutes après l'injection mais peut débuter dès 10 minutes. Les procédures efficaces d'imagerie préopératoire comprennent la scintigraphie par gamma camera planaire, la TEMP et la TEMP/TAO. Bien que ces procédures soient complémentaires d'une sonde gamma peropératoire, les images acquises de cette façon ne doivent pas être considérées comme un substitut à une sonde peropératoire efficace et complète par une sonde de détection gamma portative.
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l'Agence européenne des médicaments http://www.ema.europa.eu/.
Liste I.
Réservé à l'usage HOSPITALIER.
Trousse pour préparation radiopharmaceutique.
Le flacon contient une poudre lyophilisée stérile, non pyrogène, de couleur blanche à blanc cassé.
Flacon en verre de type I de 8 mL fermé par un bouchon en caoutchouc butylique et scellé par une capsule amovible. Chaque flacon contient 50 microgrammes de tilmanocept.
Boîte de 1 flacon.
Chaque flacon contient 50 microgrammes de tilmanocept.
Le radionucléide n'est pas inclus dans la trousse.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Tréhalose dihydraté
Glycine (E640)
Ascorbate de sodium (E301)
Chlorure stanneux dihydraté (E512)
Hydroxyde de sodium (E524)
Acide chlorhydrique dilué (E507)

